苯是最重要的基本有机化工原料之一,现利用苯,同时使用其他部分试剂,可实现如下转化: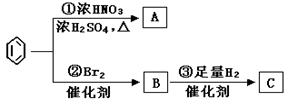
请回答下列问题:
(1)写出下列反应的化学方程式:
反应①: ;反应②: ;
(2)上述反应①~③中,属于加成反应的是 (填序号)。
(3)C的结构简式为: 。
苯是最重要的基本有机化工原料之一,现利用苯,同时使用其他部分试剂,可实现如下转化:
请回答下列问题:
(1)写出下列反应的化学方程式:
反应①: ;反应②: ;
(2)上述反应①~③中,属于加成反应的是 (填序号)。
(3)C的结构简式为: 。