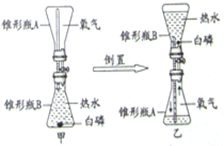
化学小组根据氨气还原氧化铜的反应,设计实验测定Cu元素的相对原子质量。已知:① 2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O ② 氨气(NH3)是碱性气体
请结合下图回答问题。
(1)将纯净干燥的氨气通入B中,观察到玻璃管内黑色固体变为亮红色,管口有液滴,同时生成空气中含量最多的气体,写出B中发生反应的化学方程式为 。
(2)测定Cu元素相对原子质量的实验过程为:先称量CuO的质量,完全反应后测定生成水的质量,由此计算出Cu元素的相对原子质量。
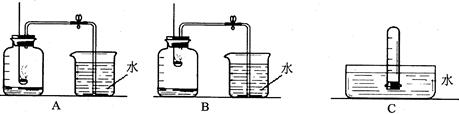
Ⅰ.小组同学利用上图进行实验,下列装置连接合理的是(填序号,装置可重复使用) 。
① ACBDC ② ADBCD ③ ADBDC ④ ABDC
Ⅱ.在本实验中,使测定结果偏大的原因可能是_______________ (填序号);
① CuO未完全起反应 ② CuO不干燥
③ CuO中混有不反应的杂质 ④ NH4C1与Ca(OH)2混合物不干燥
Ⅲ.在本实验中,还通过测定___________________________的质量达到实验目的。




 粤公网安备 44130202000953号
粤公网安备 44130202000953号