A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为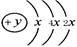 ;B、C可形成离子化合物B3C2,
;B、C可形成离子化合物B3C2,
据此利用相应的化学用语填空:
(1)A元素在周期表中的位置是 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子半径由小到大的顺序为 。
(3)B和C最高价氧化物对应水化物的化学式分别为 和 。
A、B、C、D四种短周期元素,原子序数D>A>B>C,且A、B同周期,C、D同主族,A的原子结构示意图为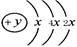 ;B、C可形成离子化合物B3C2,
;B、C可形成离子化合物B3C2,
据此利用相应的化学用语填空:
(1)A元素在周期表中的位置是 ,其气态氢化物的化学式为 。
(2)A、B、C、D四种元素的原子半径由小到大的顺序为 。
(3)B和C最高价氧化物对应水化物的化学式分别为 和 。