2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
阳离子
|
K+、Na+、Cu2+、Al3+
|
阴离子
|
SO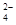 、HCO 、HCO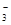 、NO 、NO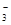 、OH- 、OH-
|
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成.
根据上述实验现象写出下列物质化学式:ABCDE