根据下图回答下列问题: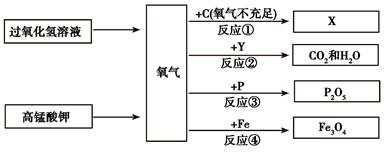
⑴生成氧气的两个反应都属于 反应(填基本反应类型),从节能、环保的角度考虑,实验室制取氧气的原理最好选用 。(用化学方程式表示)
⑵写出工业上用X从赤铁矿中炼铁的原理 (用化学方程式表示)。
⑶若反应②的化学方程式为Y+5O2点燃 3CO2+4H2O,Y的化学式为 ,其中各种元素质量比为 。
⑷写出反应③的化学方程式 。
⑸在做反应④实验时,要预先在盛放氧气的集气瓶中放 。
根据下图回答下列问题:
⑴生成氧气的两个反应都属于 反应(填基本反应类型),从节能、环保的角度考虑,实验室制取氧气的原理最好选用 。(用化学方程式表示)
⑵写出工业上用X从赤铁矿中炼铁的原理 (用化学方程式表示)。
⑶若反应②的化学方程式为Y+5O2点燃 3CO2+4H2O,Y的化学式为 ,其中各种元素质量比为 。
⑷写出反应③的化学方程式 。
⑸在做反应④实验时,要预先在盛放氧气的集气瓶中放 。