某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析: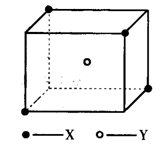
(1)晶体中每个Y同时吸引着__________个X,每个x同时吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。
某离子晶体晶胞结构如下图所示,x位于立方体的顶点,Y位于立方体中心。试分析:
(1)晶体中每个Y同时吸引着__________个X,每个x同时吸引着__________个Y,该晶体的化学式为__________ 。
(2)晶体中在每个X周围与它最接近且距离相等的X共有__________个。
(3)晶体中距离最近的2个X与1个Y形成的夹角∠XYX的度数为__________。