已知下列两个热化学方程式:
H2(g)+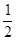 O2(g)==H2O(l) ΔH="-285" kJ/mol
O2(g)==H2O(l) ΔH="-285" kJ/mol
C3H8(g)+5O2(g)==3CO2(g)+4H2O(l)ΔH="-2" 220.0 kJ/mol
(1)实验测得H2和C3H 8的混合气体共5 mol,完全燃烧生成液态水时放热6 264.5 kJ,则混合气体中H2和C3H8的体积比是
(2)已知:H2O(l)==H2O(g)ΔH="+44.0" kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式。
已知下列两个热化学方程式:
H2(g)+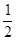 O2(g)==H2O(l) ΔH="-285" kJ/mol
O2(g)==H2O(l) ΔH="-285" kJ/mol
C3H8(g)+5O2(g)==3CO2(g)+4H2O(l)ΔH="-2" 220.0 kJ/mol
(1)实验测得H2和C3H 8的混合气体共5 mol,完全燃烧生成液态水时放热6 264.5 kJ,则混合气体中H2和C3H8的体积比是
(2)已知:H2O(l)==H2O(g)ΔH="+44.0" kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式。