0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态二氧化二碳和液态水,放出649.5kJ热量,其热化学反应方程式为 :
又知H2O(l)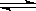 H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 J。
H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 J。
0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态二氧化二碳和液态水,放出649.5kJ热量,其热化学反应方程式为 :
又知H2O(l)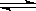 H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 J。
H2O(g);△H=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时,放出的热量是 J。