(5分) 70 ℃时,将100 g溶质的质量分数为20%的R溶液不断降温,析出固体R的质量与温度的变化关系如下图所示。根据图像回答下列问题: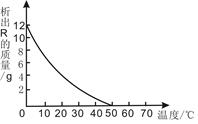
(1) R的溶解度随温度的升高而______________(填“增大”、“不变”或“减小”);
(2)从70 ℃降到50 ℃的过程中,该溶液中溶质的质量分数_________(填“变大”、“变小”或“不变”);
(3)要配制50℃时50 g R的饱和溶液,需要R的质量是 ________ g , 需要的玻璃仪器有_________ 。
(5分) 70 ℃时,将100 g溶质的质量分数为20%的R溶液不断降温,析出固体R的质量与温度的变化关系如下图所示。根据图像回答下列问题:
(1) R的溶解度随温度的升高而______________(填“增大”、“不变”或“减小”);
(2)从70 ℃降到50 ℃的过程中,该溶液中溶质的质量分数_________(填“变大”、“变小”或“不变”);
(3)要配制50℃时50 g R的饱和溶液,需要R的质量是 ________ g , 需要的玻璃仪器有_________ 。