(1)H218O和D2O分子中的中子数,前者和后者的关系是 (填序号,下同)
a.大于 b.小于 c.等于 d.无法确定
(2)化学变化中,可能发生改变的是
a.质子数 b.中子数 c.核外电子数 d.原子核
(3)右图为周期表的一部分,已知A,B,C,D,E五种元素,原子核外共有85个电子,E原子核外有四个电子层,B元素是 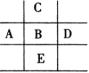
a.P b.Mg c.Cl d. Si
(1)H218O和D2O分子中的中子数,前者和后者的关系是 (填序号,下同)
a.大于 b.小于 c.等于 d.无法确定
(2)化学变化中,可能发生改变的是
a.质子数 b.中子数 c.核外电子数 d.原子核
(3)右图为周期表的一部分,已知A,B,C,D,E五种元素,原子核外共有85个电子,E原子核外有四个电子层,B元素是 
a.P b.Mg c.Cl d. Si