在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2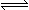 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
(1)2min内,平均反应速率v(O2)= ; v(SO3)= 。
(2)2min时,SO2的浓度为
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式
在一定条件下,向体积为2 L的容器中加入2 mol O2和3 mol SO2使之反应生成SO3气体:2SO2+ O2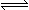 2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
2SO3,2 min时,测得O2的物质的量为1.6 mol,则:
(1)2min内,平均反应速率v(O2)= ; v(SO3)= 。
(2)2min时,SO2的浓度为
(3)若2min时测得上述反应放出Q kJ的热量,试写出该反应的热化学方程式