(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l) △H=—97.3kJ/mol
SO2Cl2(l) △H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
| A.缩小容器体积 | B.使用催化剂 | C.增加SO2浓度 | D.升高温度 |
(2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为 。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42-浓度之比为 。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。
 积关系;如图所示。计算:
积关系;如图所示。计算: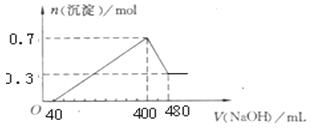
 .72g,又知生成的CO2和H2O的物质的量之比为1:1。该有机物可以使溴水褪色,能和金属钠发生反应生成H2。(1)求该有机物的分子式;(2)已知:羟基不能连接在不饱和碳原子上,该有机物的结构简式。
.72g,又知生成的CO2和H2O的物质的量之比为1:1。该有机物可以使溴水褪色,能和金属钠发生反应生成H2。(1)求该有机物的分子式;(2)已知:羟基不能连接在不饱和碳原子上,该有机物的结构简式。 粤公网安备 44130202000953号
粤公网安备 44130202000953号