(8分) 研究小组设计分离NaCl和CaCl2混合物样品方案如下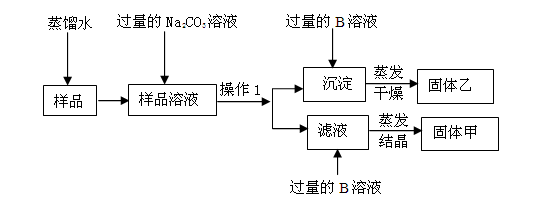
回答下列问题:固体甲是 。固体乙是 。
“操作1”是 。
Na2CO3溶液与样品溶液发生反应的化学方程式是 。
用离子符号表示滤液中含有的离子 。
过量的B溶液与沉淀发生反应的化学方程式是 。
(8分) 研究小组设计分离NaCl和CaCl2混合物样品方案如下
回答下列问题:固体甲是 。固体乙是 。
“操作1”是 。
Na2CO3溶液与样品溶液发生反应的化学方程式是 。
用离子符号表示滤液中含有的离子 。
过量的B溶液与沉淀发生反应的化学方程式是 。