(本题共8分)某研究小组向2 L密闭容器中加入过量的活性炭和0.2 mol NO,恒温(T1℃)下发生反应:C(s)+2NO(g) N2(g)+CO2(g)+Q(Q>0)。30 min后达到平衡,测得NO浓度为0.04 mol/L。回答下列问题:
N2(g)+CO2(g)+Q(Q>0)。30 min后达到平衡,测得NO浓度为0.04 mol/L。回答下列问题:
1.该反应的平衡常数表达式K=______;T1℃达到平衡时,N2的平均反应速率=_______。
2.30 min后,若改变某一条件提高NO的转化率,则可以改变的条件是______________。
3.30 min后,升高温度至T2℃,达到平衡后,容器内NO、N2、CO2的关系不可能是____。
a.5:3:3 b.1:1:1 c.4:3:3 d.2:1:1
4.若开始时密闭容器的体积为1 L,其它条件不变,达到平衡后,与原平衡相比,下列说法正确的是_________。
a.NO的转化率不变 b.N2的浓度是原来的2倍
c.反应放出的热量为0.1Q d.达到平衡的时间是原来的一半
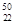 Ti与
Ti与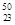 V相同的是。
V相同的是。


 粤公网安备 44130202000953号
粤公网安备 44130202000953号