人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。CO2和H2在一定条件下反应生成甲醇(CH3OH)等产生,工业上利用该反应合成甲醇。
已知:25℃,101kPa下:H2(g)+ 1/2O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+ 3/2O2(g)═CO2(g)+2H2O(g)△H2=-676kJ/mol
(1)写出CO2和H2生成气态甲醇等产物的热化学方程式______________________;
(2)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇微生物燃料电池中,电解质溶液为酸性,示意图如下图所示:
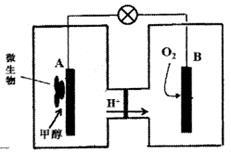
①电池外电路电子的流动方向为__________________(填写“从A到B”或“从B到A”)。
②工作结束后,B电极室溶液的酸性与工作前相比将_________(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
③A电极附近甲醇发生的电极反应式为______________ ;
(3)已知反应2CH3OH(g) CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(二甲醚)(g)+H2O(g),温度T1时平衡常数为400,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质
|
CH3OH
|
CH3OCH3
|
H2O
|
浓度/(mol•L-1)
|
0.44
|
0.6
|
0.6
|
①比较此时正、逆反应速率的大小:V正_________ V逆(填“>”“<”或“=”)。
②若加入CH3OH后,经10min反应达到平衡,此时C(CH3OH)= ______;该时间内反应速率V(CH3OH)=_____。
(4)一定条件下CO和H2也可以制备二甲醚,将amolCO与3amolH2充入一固定体积的密闭容器中,发生反应3CO(g)+3H2(g) CH3OCH3(二甲醚) (g)+CO2(g) △H<0,要提高CO的转化率,可以采取的措施是_______(填字母代号)
CH3OCH3(二甲醚) (g)+CO2(g) △H<0,要提高CO的转化率,可以采取的措施是_______(填字母代号)
a.分离出二甲醚b.加入催化剂c.充入He,使体系压强增大d.增加CO的浓度
e.再充入1molCO和3molH2