将下列物质进行分类:
①10B与11B ②O2和O3 ③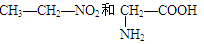
④C60和金刚石 ⑤冰和水 ⑥CH3—CH2—OH和CH3—O—CH3 ⑦ 1H+ 和2H—
(1)互为同位素的是_________ (2)互为同素异形体的是____________
(3)互为同分异构体的是___________(4)属于同一化合物的是____________
将下列物质进行分类:
①10B与11B ②O2和O3 ③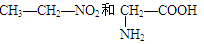
④C60和金刚石 ⑤冰和水 ⑥CH3—CH2—OH和CH3—O—CH3 ⑦ 1H+ 和2H—
(1)互为同位素的是_________ (2)互为同素异形体的是____________
(3)互为同分异构体的是___________(4)属于同一化合物的是____________