有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥。某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体。方案流程如下: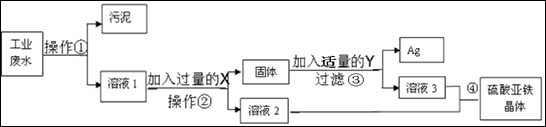
回答下列问题:
(1)操作①名称 ,该操作在实验室里使用到的玻璃仪器有:烧杯、玻璃棒、 ;
(2)加入过量的X是 ,加入该物质过量的目的是 ;
(3)步骤③中:需加入的物质Y是 ,发生反应的化学方程式是 。
有一种工业废水,其中含有大量的硫酸亚铁,少量的银离子以及污泥。某同学设计了一个既经济又合理的方法回收银和硫酸亚铁晶体。方案流程如下:
回答下列问题:
(1)操作①名称 ,该操作在实验室里使用到的玻璃仪器有:烧杯、玻璃棒、 ;
(2)加入过量的X是 ,加入该物质过量的目的是 ;
(3)步骤③中:需加入的物质Y是 ,发生反应的化学方程式是 。