无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变为CoCl2,故常在实验室用作吸湿剂和空气湿度指示剂。CoCl2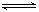 CoCl2·xH2O 现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。(1)水合物中x= ;(2)、若该化合物中Co2+的配位数为6,而且经测定得知内界和外界Cl-的个数比为1:1,则其化学式可表示为:
CoCl2·xH2O 现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。(1)水合物中x= ;(2)、若该化合物中Co2+的配位数为6,而且经测定得知内界和外界Cl-的个数比为1:1,则其化学式可表示为:
无水CoCl2为深蓝色,吸水后变为粉红色的水合物,水合物受热后又变为CoCl2,故常在实验室用作吸湿剂和空气湿度指示剂。CoCl2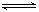 CoCl2·xH2O 现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。(1)水合物中x= ;(2)、若该化合物中Co2+的配位数为6,而且经测定得知内界和外界Cl-的个数比为1:1,则其化学式可表示为:
CoCl2·xH2O 现有65g无水CoCl2,吸水后变成CoCl2·xH2O 119g。(1)水合物中x= ;(2)、若该化合物中Co2+的配位数为6,而且经测定得知内界和外界Cl-的个数比为1:1,则其化学式可表示为: