已知NaHCO3低温时溶解度小。德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱。此过程可以表示为:
①NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应)
②2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和。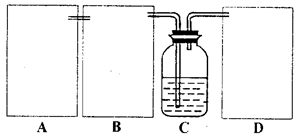
(1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下_________装置(填序号)。简述该装置能随关随停的理由________________。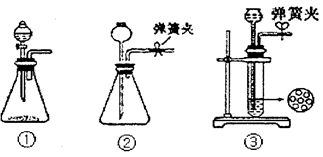
(2)为使实验能够进行,在B、D方框内补上所需装置:_________________(将装置图画在答题卡上),并指明所用试剂:_________________。
(3)该小组同学按正确的方法连接装置,检验气密性合格后进行实验,发现析出的晶体非常少。老师的指导下,他们对某个装置进行了改进,达到了实验目的。你认为他们的改进方法是___________________。
(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为______________。





 粤公网安备 44130202000953号
粤公网安备 44130202000953号