有机化合物A是一种农药生产的中间体,A在一定条件下可发生下列转化: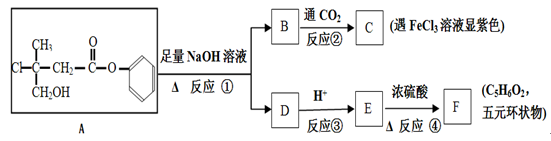
请回答下列问题:
(1)A分子中不含氧官能团的名称为。
(2)C不能发生反应的类型有(填字母)。
a.取代 b.消去 c.加成 d.氧化 e.加聚
(3)F可能的结构简式为
(4)反应①的化学方程式为。
(5)E在一定条件下反应能生成高分子化合物,其可能的结构简式为 、。
有机化合物A是一种农药生产的中间体,A在一定条件下可发生下列转化:
请回答下列问题:
(1)A分子中不含氧官能团的名称为。
(2)C不能发生反应的类型有(填字母)。
a.取代 b.消去 c.加成 d.氧化 e.加聚
(3)F可能的结构简式为
(4)反应①的化学方程式为。
(5)E在一定条件下反应能生成高分子化合物,其可能的结构简式为 、。