化合物A(C8H17Br)经NaOH醇溶液处理后生成两种烯烃B1和B2。B2(C8H16)经过1.用臭氧处理,2.在Zn存在下水解,只生成一种化合物C。C经催化氢化吸收一摩尔氢气生成醇DC4H10O.,用浓硫酸处理D只生成一种无侧链的烯烃E(C4H8.)。已知: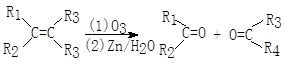
注:R1、R3可为H或其它烃基
试根据已知信息写出下列物质的结构简式:
A______________________B2_______________
C_____________________ E________________
化合物A(C8H17Br)经NaOH醇溶液处理后生成两种烯烃B1和B2。B2(C8H16)经过1.用臭氧处理,2.在Zn存在下水解,只生成一种化合物C。C经催化氢化吸收一摩尔氢气生成醇DC4H10O.,用浓硫酸处理D只生成一种无侧链的烯烃E(C4H8.)。已知: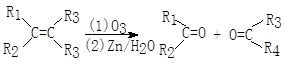
注:R1、R3可为H或其它烃基
试根据已知信息写出下列物质的结构简式:
A______________________B2_______________
C_____________________ E________________