【改编】【物质结构与性质】Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据列于下表:
元素
|
Mn
|
Fe
|
电离能kJ/mol
|
I1
|
717
|
759
|
I2
|
1509
|
1561
|
I3
|
3248
|
2957
|
回答下列问题:
(1)Mn元素核外电子的电子排布式为 ,比较两元素的I2、I3可知,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难。其原因是 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①Fe原子或离子易形成配合物的原因是 ,与Fe原子或离子形成配合物的分子或离子应具备的结构特征是 。
②络离子[Fe(CN)6]4-的配体CN-中C原子的杂化轨道类型是 ,HCN的分子构型为 ,写出一种与 CN-互为等电子体的单质分子的电子式 。
(3)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上升华。易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体构成微粒为 。
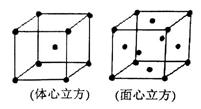
(4)金属铁晶体在不同的温度下有两种堆积方式,如图所示。体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为 。