已知NO2和N2O4之间发生可逆反应: 2NO2 (g) (红棕色) N2O4(g) (无色)
(1)在烧瓶A和B中盛有相同浓度的NO2和N2O4的混合气体,中间用止水夹夹紧,浸入到盛有水的烧杯中,如图所示。
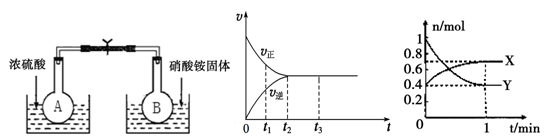
分别向两个烧杯中加入浓硫酸和NH4NO3固体,观察到的现象是:A中气体红棕色加深,B中 。这说明,当条件改变时,原来的化学平衡将被破坏,并在新的条件下建立起新的平衡,即发生化学平衡的移动。下列条件的改变,能使该反应化学平衡正向移动的是 。
a.及时分离出NO2气体 b.适当降低温度
c.增大压强 d.选择高效催化剂
(2)下图是在一定温度下,某固定容积的密闭容器中充入一定量的NO2气体后,反应速率(v)与时间(t)的关系曲线。下列叙述正确的是 。
a.t1时,反应未达到平衡, NO2浓度在减小
b.t2时,反应达到平衡,反应不再进行
c.t2~t3,各物质浓度不再变化
d.t2~t3,各物质的浓度相等
e.0~t2,N2O4浓度增大
f.反应过程中气体的颜色不变
(3)某容积2L的密闭容器中充入一定量的NO2和N2O4的混合气体,在一定温度压强下,两者物质的量随时间变化如图所示。
①表示NO2变化的曲线是 (填“X”或“Y”)。
②在0到1 min内用Y的浓度变化表示的该反应的反应速率是 mol•L-1•min-1
③计算该反应平衡时化学反应平衡常数K= 。