某金属A及其化合物之间有如下的转化关系: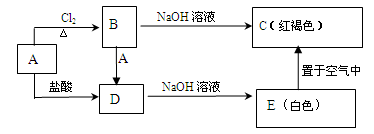
试回答下列问题:
(1)D的溶液与NaOH 溶液混合后的现象是
。
(2)反应B转化成D的离子方程式是 。
(3)把B溶液滴入沸水中可以得到红褐色的液体,用一束光通过该液体产生 。
某金属A及其化合物之间有如下的转化关系:
试回答下列问题:
(1)D的溶液与NaOH 溶液混合后的现象是
。
(2)反应B转化成D的离子方程式是 。
(3)把B溶液滴入沸水中可以得到红褐色的液体,用一束光通过该液体产生 。