(8分)有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)。回答下列问题: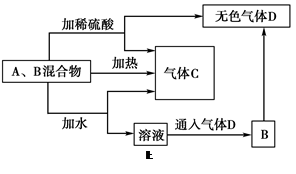
(1)写出A的电子式____________。
(2)①E溶液加少量稀硫酸的化学方程式_______________________________。
②B加稀硫酸产生D的离子方程式_______________________________。
(3)请用化学方程式表示A在潜水艇中的一种重要用途__________________________。
(8分)有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)。回答下列问题:
(1)写出A的电子式____________。
(2)①E溶液加少量稀硫酸的化学方程式_______________________________。
②B加稀硫酸产生D的离子方程式_______________________________。
(3)请用化学方程式表示A在潜水艇中的一种重要用途__________________________。