A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色粉末,它们的转化关系如图所示。请回答: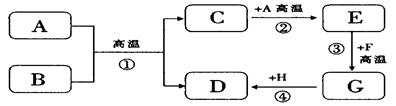
①物质B的化学式为 ;
②反应③的化学方程式为 ;
③写一个能实现反应④的化学方程式 ;
A~H都是初中化学中常见的物质,已知B为黑色固体,D为红色固体单质,F为红色粉末,它们的转化关系如图所示。请回答:
①物质B的化学式为 ;
②反应③的化学方程式为 ;
③写一个能实现反应④的化学方程式 ;