浓硫酸和碳在加热的情况下反应的化学方程式为C+2H2SO4=CO2↑+2SO2↑+2H2O为了验证反应的各种生成物,用如图Ⅰ装置进行实验。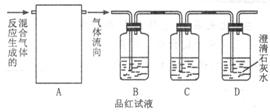
图Ⅰ
(1)图Ⅰ中A处是完成实验中的必要装置,它是下列图Ⅱ所示中的(填编号)_________;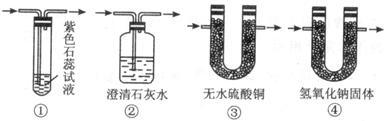
图 Ⅱ
(2)C装置中应盛的试剂为足够_______________,其作用__________;
(3)能够确定存在二氧化碳气体的实验现象_______________________。
浓硫酸和碳在加热的情况下反应的化学方程式为C+2H2SO4=CO2↑+2SO2↑+2H2O为了验证反应的各种生成物,用如图Ⅰ装置进行实验。
图Ⅰ
(1)图Ⅰ中A处是完成实验中的必要装置,它是下列图Ⅱ所示中的(填编号)_________;
图 Ⅱ
(2)C装置中应盛的试剂为足够_______________,其作用__________;
(3)能够确定存在二氧化碳气体的实验现象_______________________。