有如图电化学装置,以多孔石墨为电极、AgNO3为电解质溶液。改变开关K1、K2的闭合状态,回答下列问题。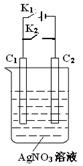
(1)若打开K2、闭合K1,此时,该装置为 (原电池或电解池),C1上发生的电极反应式为:  。
。
(2)当两电极质量不再改变时,断开K1、闭合K2。此时,C1上发生的电极反应式为: ,电化学装置内发生的总反应方程式: 。
有如图电化学装置,以多孔石墨为电极、AgNO3为电解质溶液。改变开关K1、K2的闭合状态,回答下列问题。
(1)若打开K2、闭合K1,此时,该装置为 (原电池或电解池),C1上发生的电极反应式为:  。
。
(2)当两电极质量不再改变时,断开K1、闭合K2。此时,C1上发生的电极反应式为: ,电化学装置内发生的总反应方程式: 。