如下图为相互串联的甲、乙两电解池。试回答: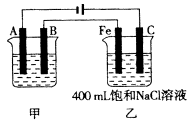
(1)若甲电解池利用电解原理在铁上镀银,则B是(填电极材料),电极反应为,甲中电解质溶液的溶质为__________。
(2)若甲电解池某极增重4.32g,则乙槽中Fe极上放出的气体在标准状况下的体积是__________mL。
(3)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于__________。
如下图为相互串联的甲、乙两电解池。试回答:
(1)若甲电解池利用电解原理在铁上镀银,则B是(填电极材料),电极反应为,甲中电解质溶液的溶质为__________。
(2)若甲电解池某极增重4.32g,则乙槽中Fe极上放出的气体在标准状况下的体积是__________mL。
(3)若乙电解池中剩余溶液仍为400mL,则电解后所得溶液的pH等于__________。