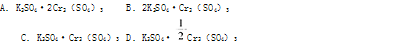两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO2—4,若将2.83gX中的Cr3+,全部氧化为Cr2O2-7后,溶液中的Cr2O2-7可和过量KI溶液反应,得到3.81gI2,反应的离子方程为:Cr2O2-7+6I—+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为( )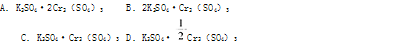
两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出K+、Cr3+、SO2—4,若将2.83gX中的Cr3+,全部氧化为Cr2O2-7后,溶液中的Cr2O2-7可和过量KI溶液反应,得到3.81gI2,反应的离子方程为:Cr2O2-7+6I—+14H+=2Cr3++3I2+7H2O。若向溶有2.83gX的溶液中,加入过量的BaCl2溶液,可得到4.66g白色沉淀。由此可推断出X的化学式为( )