下列为一些常见物质的相互转化关系图。已知:A是生活生产中常用的一种金属单质,B为淡黄色粉末,C在常温下为无色液体,H为白色沉淀,J为红褐色沉淀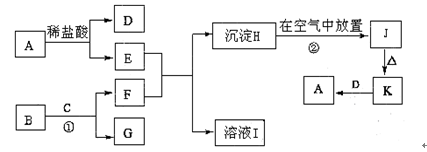
请写出:
(1) A、B的化学式为:A ,B 。
(2)过程②中的反应现象: 。
(3)反应①的化学方程式 。
下列为一些常见物质的相互转化关系图。已知:A是生活生产中常用的一种金属单质,B为淡黄色粉末,C在常温下为无色液体,H为白色沉淀,J为红褐色沉淀
请写出:
(1) A、B的化学式为:A ,B 。
(2)过程②中的反应现象: 。
(3)反应①的化学方程式 。