将0.23 mol SO2和0.11 mol O2放入容积为1 L的密闭容器中,发生反应2SO2+O2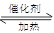 2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度 (填“增大”“不变”或“减小”),氧气的转化率 (填“升高”“不变”或“降低”),SO3的体积分数 (填“增大”“不变”或“减小”)。
2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度 (填“增大”“不变”或“减小”),氧气的转化率 (填“升高”“不变”或“降低”),SO3的体积分数 (填“增大”“不变”或“减小”)。
将0.23 mol SO2和0.11 mol O2放入容积为1 L的密闭容器中,发生反应2SO2+O2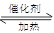 2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度 (填“增大”“不变”或“减小”),氧气的转化率 (填“升高”“不变”或“降低”),SO3的体积分数 (填“增大”“不变”或“减小”)。
2SO3,在一定温度下,反应达到平衡,得到0.12 mol SO3,则反应的平衡常数K= 。若温度不变,再加入0.50 mol氧气后重新达到平衡,则SO2的平衡浓度 (填“增大”“不变”或“减小”),氧气的转化率 (填“升高”“不变”或“降低”),SO3的体积分数 (填“增大”“不变”或“减小”)。