一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+ B(g) xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确的是
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确的是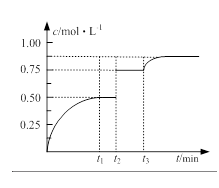
| A.反应方程式中的x=1 |
| B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是移去少量物质D |
| D.t1~t3间该反应的平衡常数均为4 |
一定温度下,将1molA和1molB气体充入2L恒容密闭容器,发生反应A(g)+ B(g) xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确的是
xC(g)+D(s),t1时达到平衡。在t2、t3时刻分别改变反应的一个条件,测得容器中气体C的浓度随时间变化如图所示。下列说法正确的是
| A.反应方程式中的x=1 |
| B.t2时刻改变的条件是使用催化剂 |
| C.t3时刻改变的条件是移去少量物质D |
| D.t1~t3间该反应的平衡常数均为4 |