(10分)降低大气中CO2的含量及有效地开发利用CO2,目前工业上有一种方法是用CO2来生产甲醇燃料。为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH =-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH =-49.0kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
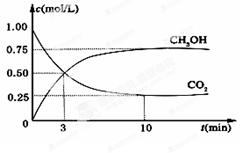
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________mol/(L·min);
(2)氢气的转化率=________;
(3)该反应的平衡常数为________(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是________。
| A.升高温度 |
| B.充入He(g),使体系压强增大 |
| C.将H2O(g)从体系中分离出去 |
| D.再充入1mol H2 |
(5)当反应达到平衡时,H2的物质的量浓度为c1,然后向容器中再加入一定量H2,待反应再一次达到平衡后,H2的物质的量浓度为c2,则c1________c2的关系(填“>”、“<”或“=”)。