将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行离子的依次分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)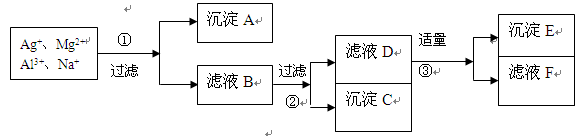
(1)沉淀A是 ___,沉淀C ___,沉淀E是 ;
(2)加入试剂①是 ____,②是________________,③是______________。
将含有Ag+、Mg2+、Al3+、Na+等离子的稀溶液,按下列实验步骤进行离子的依次分离。填写下列空白(各步可使用的试剂限于在NaOH、HCl、NaCl中选择)
(1)沉淀A是 ___,沉淀C ___,沉淀E是 ;
(2)加入试剂①是 ____,②是________________,③是______________。