2-甲基丙烯是制备有机玻璃的主要原料。现以2-甲基丙烯为原料,通过下列合成路线合成有机玻璃F。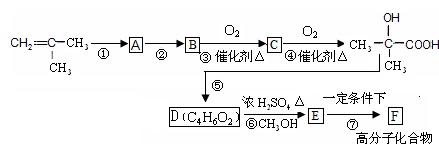
根据上述过程回答下列问题:
(1)、填写反应类型:反应⑦是 ,反应⑤是 。
(2)、写出结构简式:B F 。
(3)、写出物质D中所含官能团的名称: 。
(4)、写出反应③的化学方程式 。
2-甲基丙烯是制备有机玻璃的主要原料。现以2-甲基丙烯为原料,通过下列合成路线合成有机玻璃F。
根据上述过程回答下列问题:
(1)、填写反应类型:反应⑦是 ,反应⑤是 。
(2)、写出结构简式:B F 。
(3)、写出物质D中所含官能团的名称: 。
(4)、写出反应③的化学方程式 。