(6分)处理含CN-(其中C为+ 2价)的工业废水常用Cl0_氧化,生成的CNO (其中C为+4价),反应的离子方程式为:
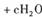 ,上述离子方程式可能的配平系数有多组。请回答:
,上述离子方程式可能的配平系数有多组。请回答:
(1) 该离子方程式中e:f的值是________(填选项标号)。
| A.0.5 | B.1 | C.2 | D.不能确定 |
(2) 若d="e" =l,则b=________
(3)若反应中转移1.2mol电子,则生成的气体在标况的体积是________。
(6分)处理含CN-(其中C为+ 2价)的工业废水常用Cl0_氧化,生成的CNO (其中C为+4价),反应的离子方程式为:
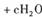 ,上述离子方程式可能的配平系数有多组。请回答:
,上述离子方程式可能的配平系数有多组。请回答:
(1) 该离子方程式中e:f的值是________(填选项标号)。
| A.0.5 | B.1 | C.2 | D.不能确定 |
(2) 若d="e" =l,则b=________
(3)若反应中转移1.2mol电子,则生成的气体在标况的体积是________。