现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| A |
原子的电子排布图为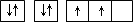 |
| B |
常温下单质为双原子分子,原子间形成三对共用电子对 |
| C |
原子的s轨道电子数等于p轨道电子数,元素的最低负价为-2价 |
| D |
二价阳离子与C的阴离子具有相同的电子层结构 |
| E |
原子序数是D两倍, |
根据以上情况,回答下列问题:(答题时A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的电负性由小到大的顺序为 ;
(2)B的氢化物的分子空间构型是 ,该氢化物的等电子体是 ;
(3)E的价电子排布式是 ,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界,ECl3形成的配合物的化学式为 ;
(4)AC2在高温高压下所形成的晶胞如图所示。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中A原子的杂化形式为 ;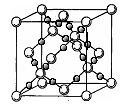
(5)D 的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因: 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号