在硫酸铝、硫酸钾和明矾的混合溶液中,测得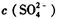 =0.4 mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
=0.4 mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
| A.0.225 mol/L | B.0.25 mol/L | C.0.45 mol/L | D.0.9 mol/L |
在硫酸铝、硫酸钾和明矾的混合溶液中,测得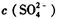 =0.4 mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
=0.4 mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
| A.0.225 mol/L | B.0.25 mol/L | C.0.45 mol/L | D.0.9 mol/L |