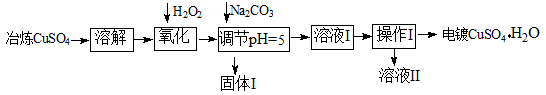
从固体混合物A出发可以发生如下框图所示的一系列变化。
(1)在实验室,气体C的检验方法是 。
(2)操作②的名称是 ,该操作所使用的玻璃仪器有 。
(3)写出下列反应的离子方程式:
反应③ ;
反应④ 。
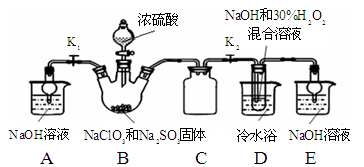
实验中多余的气体I必须吸收,以免污染空气。下图是实验室用NaOH吸收气体I的装置,为防止产生倒吸现象,不合理的装置是 (填序号)。


 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+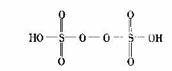
 粤公网安备 44130202000953号
粤公网安备 44130202000953号