下图中每一方框中的字母代表一种反应物或生成物(部分产物未列出):
已知C是紫红色金属固体,B的浓溶液和稀溶液都是有强氧化性。
(1)A的化学式是 ,E化学式是 ;
(2)电解反应的化学(或离子)方程式是 ;
(3)对200ml 1mol/L的A溶液进行电解,当有0.02mol电子发生转移时,溶液的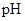 为
为
(假设溶液体积不变)。
下图中每一方框中的字母代表一种反应物或生成物(部分产物未列出):
已知C是紫红色金属固体,B的浓溶液和稀溶液都是有强氧化性。
(1)A的化学式是 ,E化学式是 ;
(2)电解反应的化学(或离子)方程式是 ;
(3)对200ml 1mol/L的A溶液进行电解,当有0.02mol电子发生转移时,溶液的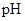 为
为
(假设溶液体积不变)。