. 用双线桥法表示下列化学反应中的电子转移情况,是离子反应的将其改写为离子方程式,不是离子反应的可不填.
(1) 加热硝酸铵
5NH4NO3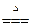 4N2↑+2HNO3+9H2O
4N2↑+2HNO3+9H2O
(2)在含有Na2S和Na2SO3的溶液中,加入稀硫酸
2Na2S+Na2SO3+3H2SO4==3Na2SO4+3S↓+3H2O
(3)铜片与稀硝酸反应
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO+4H2O
. 用双线桥法表示下列化学反应中的电子转移情况,是离子反应的将其改写为离子方程式,不是离子反应的可不填.
(1) 加热硝酸铵
5NH4NO3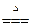 4N2↑+2HNO3+9H2O
4N2↑+2HNO3+9H2O
(2)在含有Na2S和Na2SO3的溶液中,加入稀硫酸
2Na2S+Na2SO3+3H2SO4==3Na2SO4+3S↓+3H2O
(3)铜片与稀硝酸反应
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO+4H2O