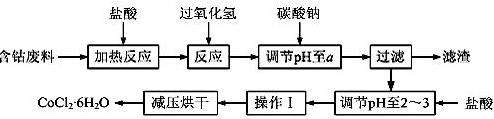
CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
已知:
①钴与盐酸反应的化学方程式为:Co+2HCl=CoCl2+H2↑
②CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴。
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物
|
Fe(OH)3
|
Fe(OH)2
|
Co(OH)2
|
Al(OH)3
|
开始沉淀
|
2.3
|
7.5
|
7.6
|
3.4
|
完全沉淀
|
4.1
|
9.7
|
9.2
|
5.2
|
请回答下列问题:
(1)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点为 。
。
(2)加入碳酸钠调节pH至a,a的范围是;
(3)操作Ⅰ包含3个基本实验操作,它们是、和过滤。
(4)制得的CoCl2·6H2O需减压烘干的原因是 。
(5)为测定产品中CoCl2·6H2O含量,某同学将一定量的样品溶于水,再向其中加入足量的AgNO3溶液,过滤,并将沉淀烘干后称量其质量。通过计算发现产品中CoCl2·6H2O的质量分数大于100%,其原因可能是(任写1点)。
 p C在某温度下达到平衡。
p C在某温度下达到平衡。 p C在某温度下达到平衡。
p C在某温度下达到平衡。