(10分)在密闭容器里,通入x mol H2(g)和y molI2(g),发生反应
H2(g)+I2(g) 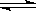 2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1)升高温度 ; (2)扩大容器的体积 ;
(3)充入更多的H2 ; (4)容器容积不变,通入氖气 ;
(10分)在密闭容器里,通入x mol H2(g)和y molI2(g),发生反应
H2(g)+I2(g) 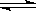 2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
2HI(g) △H<0。改变下列条件,反应速率将如何改变?(填“增大”“减小”或“不变”)
(1)升高温度 ; (2)扩大容器的体积 ;
(3)充入更多的H2 ; (4)容器容积不变,通入氖气 ;