下表是某食品包装袋上的说明,从表中的配料中分别选出一种物质填在相应的横线上(填相应字母)。
| 品 名 |
××× |
| 配 料 |
A鲜鸡蛋 B精面粉 C白砂糖 D精炼植物油 E奶粉 F食盐 G柠檬汁等 |
| 保质期 |
240天 |
| 生产日期 |
标于包装袋封口上 |
① 富含蛋白质的是_____________________。②富含糖类的是_______________________。
③富含油脂的是_______________________。④富含维生素的是_____________________。
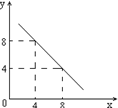
 Ba 2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到mol·L一1
Ba 2+ (aq)+ SO42-(aq) 25℃时,BaSO4的Ksp=1.1×l0—10,在0.1 mol·L一1硫酸溶液中,钡离子的浓度最大可达到mol·L一1
 粤公网安备 44130202000953号
粤公网安备 44130202000953号