如图,A、B、C、D、E各代表碳、铁、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。请填空: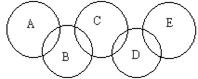
(1)写出下列物质的化学式:A ,B ,D 。
(2)写出下列反应的离子方程式:
B+C: ,
(3)相连环物质间发生的反应中,氧化还原反应共有 个。
如图,A、B、C、D、E各代表碳、铁、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。请填空:
(1)写出下列物质的化学式:A ,B ,D 。
(2)写出下列反应的离子方程式:
B+C: ,
(3)相连环物质间发生的反应中,氧化还原反应共有 个。