某学生设计了如下实验: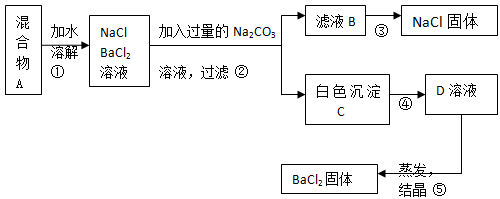
(1)该同学的实验目的是____________________________;
(2)上图③操作步骤为________________,④加入试剂为 ;
(3)按此实验方案得到的NaCl固体中肯 定含有__________(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______________;
定含有__________(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______________;
(4)写出生成C的化学方程式____________________________。
某学生设计了如下实验:
(1)该同学的实验目的是____________________________;
(2)上图③操作步骤为________________,④加入试剂为 ;
(3)按此实验方案得到的NaCl固体中肯 定含有__________(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______________;
定含有__________(填化学式)杂质;为了解决这个问题可以向过滤得到的滤液中加入适量的______________;
(4)写出生成C的化学方程式____________________________。