CO是常见的化学物质,在工业生产中用途很广泛。
(1) 已知:某些反应的热化学方程式如下:
2H2(g)+SO2(g)=S(g)+2H2O(g) ΔH=+90.4kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-556.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol-1
请写出用CO除去空气中SO2,生成S(g)及CO2热化学方程式
(2) 某燃料电池以CO为燃料,以空气为氧化剂,以熔融态的K2CO3为电解质,请写出该燃料电池正极的电极反应式;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2H2(g)+CO(g) CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
CH3OH(g);△H=-dJ·mol-1(d>0)。初始投料与各容器达到平衡时的有关数据如下:
实验
|
甲
|
乙
|
丙
|
初始投料
|
2 molH2、1 molCO
|
1 mol CH3OH
|
4 molH2、2 molCO
|
平衡时n(CH3OH )
|
0.5mol
|
n2
|
n3
|
反应的能量变化
|
放出Q1kJ
|
吸收Q2kJ
|
放出Q3kJ
|
体系的压强
|
P1
|
P2
|
P3
|
反应物的转化率
|
α1
|
α2
|
α3
|
①该温度下此反应的平衡常数K为。
②三个容器中的反应分别达平衡时各组数据关系正确的是(填序号)。
A.α1+α2=1 B.Q1+Q2=d
C.α3<α1D.P3>2P1=2P2
E.n2<n3<1.0mol F.Q3<2Q1
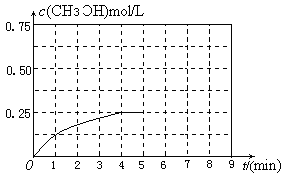
③在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡,从开始到新平衡时H2的转化率为65.5%,请在下图中画出第5min 到新平衡时CH3OH的物质的量浓度的变化曲线。
(4)实验室常用甲酸(一元酸)来制备CO。已知25℃时,0.l mol/L甲酸( HCOOH)溶液和0.l mo1/L乙酸溶液的pH分别为2.3和2.9。现有相同物质的量浓度的下列四种溶液:①HCOONa溶液 ②CH3COONa溶液③Na2CO3④NaHCO3溶液,其pH由大到小的顺序是____(填写溶液序号)。关于0.l mo1/L HCOOH溶液和0.l mo1/LHCOONa等体积混合后的溶液描述正确的是____。
a.c(HCOOˉ)>c(HCOOH)>c(Na+)>c(H+)
b.c(HCOOˉ)+c(HCOOH)=" 0.2" mo1/L
c.c(HCOOˉ)+2c(OHˉ)=c(HCOOH)+2c(H+)
d.c(HCOOˉ) >c(Na+)>c(H+)>c(OHˉ)
 MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2与浓盐酸反应制取氯气,其反应的化学方程式为: mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol 。
mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol 。 MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2与浓盐酸反应制取氯气,其反应的化学方程式为: mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol 。
mol Cl2生成,被氧化的HCl的物质的量是 mol,转移电子的物质的量是 mol 。