雄黄(AS4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
⑴As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,该反应的化学方程式为 。
⑵上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
⑶As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O,若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 极附近逸出。
⑷将⑶中反应产物NO2充满干燥的烧瓶,然后将烧瓶倒立于少水槽中,向烧瓶中通入一定量的氧气,气体恰好完全溶于水(假设溶液没有扩散),则烧瓶中溶液溶质的物质的量浓度为 (设该条件下的气体摩尔体积为23.8 ,结果保留到小数点后三位)。
,结果保留到小数点后三位)。
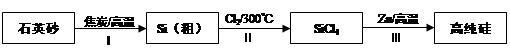
 Na2SO4 + Na2SnS3+ CO2↑。
Na2SO4 + Na2SnS3+ CO2↑。 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5. 粤公网安备 44130202000953号
粤公网安备 44130202000953号