在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体化合物、B为金属单质,D、E、M是常见气体单质,其中I为红褐色固体,M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断: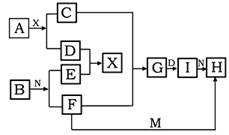
(1)写出下列化学式 A I
(2)F+M→H离子方程式为
(3)A+X→C+D的化学方程式为__________ _____________________
在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体化合物、B为金属单质,D、E、M是常见气体单质,其中I为红褐色固体,M为黄绿色,N是胃酸的主要成分,工业上用E和M来制取N,试推断:
(1)写出下列化学式 A I
(2)F+M→H离子方程式为
(3)A+X→C+D的化学方程式为__________ _____________________